研究丨仿制药企业视角下的专利声明及其策略
来源: 道可特律所 时间: 2024-01-03 22:57:10 作者: 刘元霞
目录
一、中国药品专利链接制度运行的相关数据简介
二、仿制药视角下的专利声明策略
(一)登记错误问题的应对
(二)专利声明是否错误的相关案例
(三)4.1类声明
(四)4.2类声明问题
三、总结
一、中国药品专利链接制度运行的相关数据简介
我国药品专利登记一般可以在中国上市药品专利信息登记平台上检索。
我国可登记的药品专利类型,根据《药品专利纠纷早期解决机制实施办法(试行)》来看,共以下几类:
1.化学药品(不含原料药):药物活性成分化合物专利、含活性成分的药物组合物专利、医药用途专利;
2.中药:中药组合物专利、中药提取物专利、医药用途专利;
3.生物制品:活性成分的序列结构专利、医药用途专利。
4.相关专利不包括中间体、代谢产物、晶型、制备方法、检测方法等的专利。
截至2023年10月8日,我国药品专利登记数据统计如下:
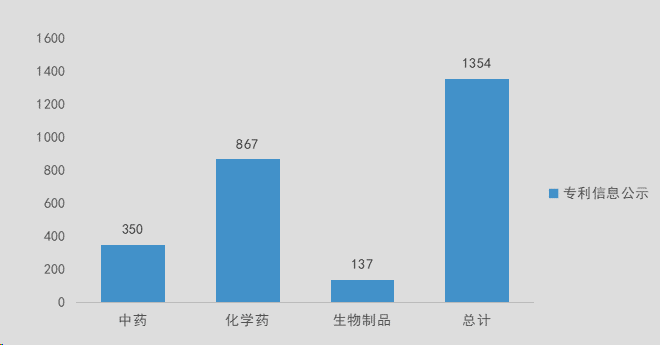
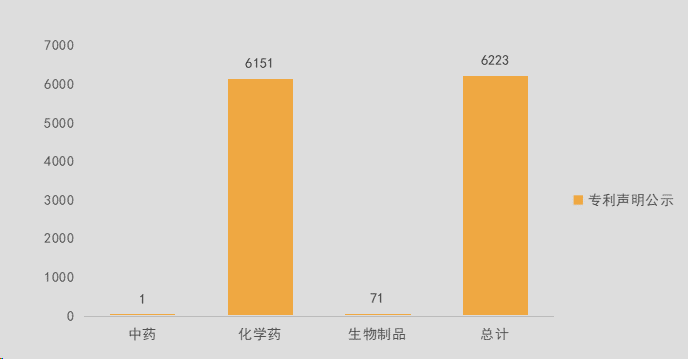
我国药品专利声明数据统计如下:
从相关裁判结果来看,截至2023年8月30日,基于公开渠道不完全统计,我国药品专利确认之裁和确认之诉数据统计如下:

二、仿制药视角下的专利声明策略
针对部分药品专利相关的重点问题,以下介绍一些仿制药视角下的专利声明策略,供大家参考。
(一)登记错误问题的应对
该类案件的争议是:“晶型的专利”的认定问题。涉及“晶型”的代表性案例如下,其相关的认定结果也不同:

该结果表明,达格列净晶型的制药用途专利,是否属于“晶型的专利”,一审和二审出现了不一样的认定。
案例一:达格列净片((2023)最高法知民终7号)
根据公开平台检索,达格列净片专利登记情况如下:
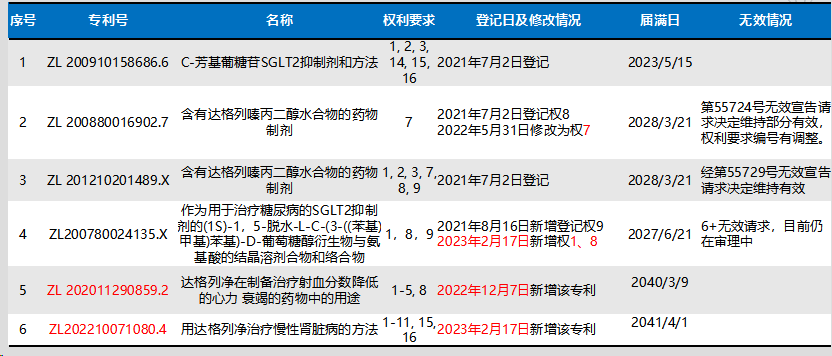
达格列净片专利声明情况(ZL200780024135.X)如下:
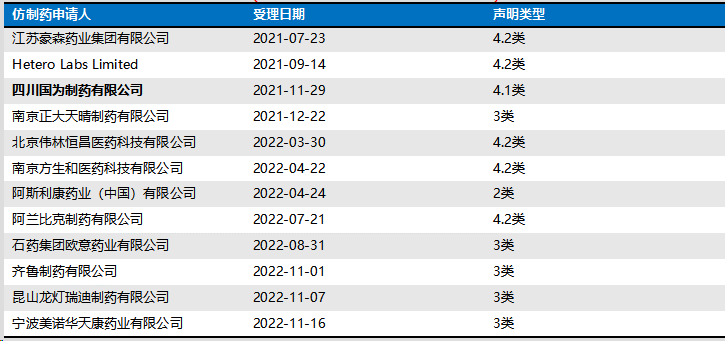
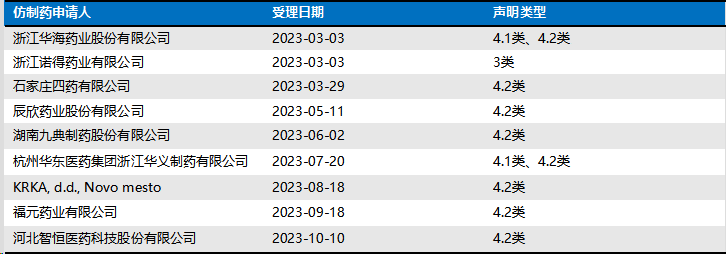
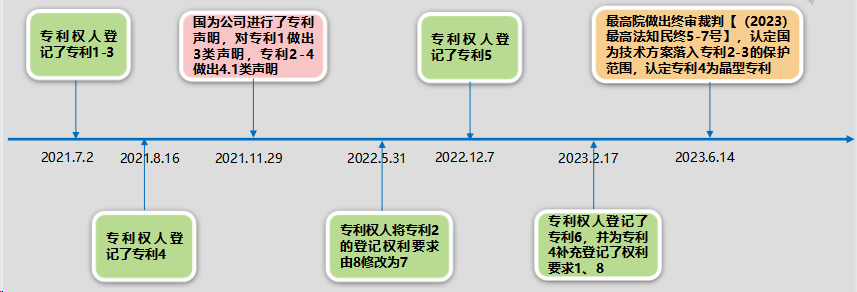
事实时间表如下:
该案的涉案权利要求撰写如下:
1.具有式Ia的结晶结构其特征在于粉末X-射线衍射图如图1所示。
9.权利要求1所述的结晶结构在制备用于治疗哺乳动物的糖尿病、胰岛素抵抗、高血糖、高胰岛素血症、脂肪酸或甘油的升高的血含量、高脂血、血脂障碍、肥胖、或糖尿病并发症的药物方面的用途。——专利权人仅登记了该权利要求。
最高人民法院主要从如下三个角度来论述:
①从文义解释的角度看,药品专利纠纷实施办法第五条已对药品化合物专利、药品组合物专利作出限定的前提下,如果对医药用途专利不作任何限定,则会出现本不可登记的药品化合物、药品组合物对应的医药用途专利却可以登记的情形,这显然不符合对前两种类型专利限定的本意,亦不符合规范性文件的行文逻辑,更会不当扩大可登记的专利范围。第五条规定中的“医药用途专利”应结合该规定的整体文义进行理解,将其解释为药物活性成分化合物的医药用途专利和含活性成分的药物组合物的医药用途专利。
②从目的解释的角度看,药品专利纠纷早期解决机制是一种兼顾原研药专利权人和仿制药申请人及社会公众利益的特殊机制。药品专利纠纷早期解决机制并非解决药品专利纠纷的唯一途径,对适用于这一特殊机制的药品专利范围原则上不能随意作扩大解释。对于在已有的以分子结构表达的化合物基础上进一步以晶体晶胞参数和空间群、晶体XRPD图(数据)、固相NMR图(数据)等特征表征结晶结构的化合物专利,其一般是在分子结构层面的化合物发挥药理活性的基础上通过限定分子的具体排列方式而进一步改进生物利用度等效果,综合考虑药品专利纠纷早期解决的特点和药品专利纠纷实施办法第五条对“药物活性成分化合物专利”的限定,尚不宜将该类专利纳入可登记专利范围。
③从历史解释的角度看,实施办法政策解读从反向强调“相关专利不包括中间体、代谢产物、晶型、制备方法、检测方法等的专利”,表明有关行政主管机关在制定药品专利纠纷实施办法时已考虑过所谓的晶型专利,并有意将之排除在可登记专利范围之外。
2.总结
该案中,一审和二审对于是否属于“晶型的专利”有不一样的认定。最终最高院对此认定结果与国知局此前再“奈拉替尼”案中的认定一致。但现实中,何种属于晶型专利,争议仍然较大,主要原因在于对于该认定是限缩解释还是扩大解释的问题。从达格列净案判决可以看出,“晶型的专利”如果是活性成分的结构已知,那么就会被认定为“已有的以分子结构表达的化合物”。如果权利要求没有结构表征,而是在化合物的基础上采用晶型的表征方式,如使用晶体晶胞参数和空间群、晶体XRPD图(数据)、固相NMR图(数据)、红外、拉曼光谱等,会认定为属于最高院所解释的“晶型的专利”。
但这也有问题。第一,何为分子已知?如果形成了溶剂合物(例如达格列净丙二醇溶剂合物),这属于分子已知吗?共晶溶剂合物,属于分子已知吗?有观点认为达格列净属于已知分子,但结合上丙二醇的溶剂合物就是一个新的分子了;还有缬沙坦沙库比曲复合物,单独的缬沙坦或者沙库比曲是分子已知,但两者结合在一起形成的复合物是一个新的分子。第二,何为晶型?是采用了“其为结晶形式”等类似表征方式的,就属于晶型?还是采用了晶胞参数等参数限定的属于晶型?还是必须只能是XRD、晶胞参数等最高院判决中罗列的参数限定才属于晶型,其他的参数限定,就不属于晶型?这些问题一直都是有争议且仍未解决的。我们将持续关注。
(二)专利声明是否错误的相关案例
案例二:哌柏西利案((2023)最高法知民终1233号)
哌柏西利片专利登记了ZL 03802556.6,2023.1.9保护期届满,各仿制药申请人所作声明如下,其中齐鲁制药做了一类声明。
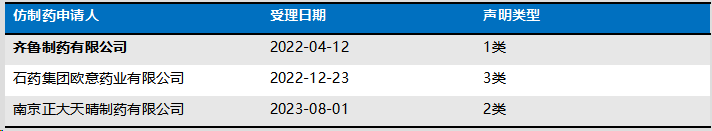
该案的事实时间表如下:
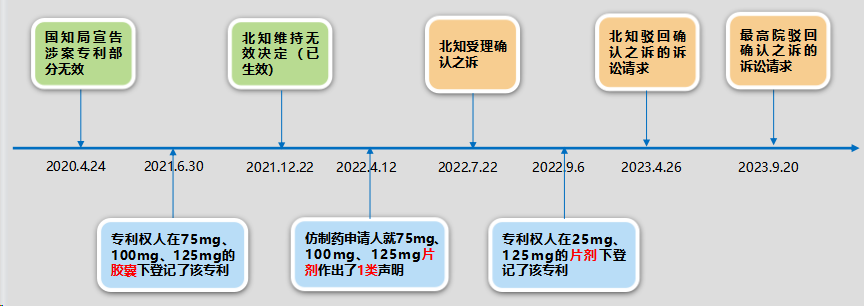
(1)4类声明的应然与实然
因为4类声明是法院受理相关案件的构成要件,所以要考察法院如何看待4类声明。北京知识产权法院对4类声明的应然与实然的观点是:①如果是实然状态,只要是未登记为4类声明,即应认定其不符合受理条件。②如果对受理条件的判断中完全以登记的声明类型为准,则客观上至少可能导致以下两种情形:A仿制药申请人通过有意做出虚假声明以规避诉讼;B仿制药申请人因理解错误而导致登记错误。③无论哪一种情形,均会影响药品专利纠纷早期解决机制制度价值的充分体现。据此可以知悉,法院在受理相关案件时,是以实然状态为标准的。对于本案,虽然齐鲁制药登记为1类声明,但存在登记错误的可能,所以北知仍然予以受理。
(2)“被仿制药的相关专利”的具体理解
对于“被仿制药的相关专利”的具体理解,北京知识产权法院的观点是:
①药品专利纠纷早期解决机制的设立目的,不在于解决通常意义上的药品专利纠纷,而在于解决与在中国境内注册上市药品相关的专利纠纷。故该机制的核心既包括专利因素,又包括药品因素。
②对于未在中国注册上市的药品,即便其相关专利已在中国获得授权,且相关专利覆盖的其他药品已在中国上市,其仍不符合药品专利纠纷早期解决机制的保护前提。
对于本案而言,因为齐鲁制药在做出专利声明之时,沃尼尔·朗伯公司的胶囊剂并未进入中国市场,由此导致与专利相关的药品并未获批,即没有“药品因素”这一前提,沃尼尔·朗伯公司也无法在登记平台做出与胶囊剂相关的专利登记,齐鲁制药据此做出1类声明是正确的。故一审判决就该案最终认定不予受理。
最高人民法院观点认为:
①首先,从体系解释的角度看……在对该条中“被仿制药每一件相关的药品专利”进行解释时,应延续前述条款的理解,“被仿制药”与“相关的药品专利”之间应该满足前述第四条第一款所规定的被仿制药与相关专利权利要求间存在对应关系的条件,且存在该对应关系的专利权利要求已被登记于专利信息登记平台。因此,这里的“被仿制药”应该是指已经在中国上市的被仿制药,而“相关的药品专利”应该是指与已在中国上市的被仿制药相对应地登记在专利信息登记平台的专利。若按照沃尼尔·朗伯公司的解释,将此处的“被仿制药”解释为包括未在中国上市的药品,“相关的药品专利”可能包含专利信息登记平台中的任何专利,则此种解释明显与药品专利纠纷实施办法前述条款中相关规定存在冲突,不符合体系解释的原则……
②其次,从目的解释的角度看……药品专利纠纷早期解决机制并非解决药品专利纠纷的唯一途径,对适用于这一特殊机制的药品专利范围原则上不能随意作扩大解释。若按照沃尼尔·朗伯公司的理解,将“相关的专利”解释为可能包含专利信息登记平台中的任何专利,则可能不当地增加了仿制药申请人确定声明类别的负担,影响该机制的平稳有效运行……齐鲁公司在专利信息登记平台作出声明的时间亦早于哌柏西利片原研药登记于专利信息登记平台的时间,在此情形下,齐鲁公司作出一类声明符合药品专利纠纷实施办法的规定,并无不当。
(3)“三类仿制药专利声明”的具体理解
对于“三类仿制药专利声明”的具体理解,北京知识产权法院认为:
①化学药品分类中的3类药品,是指境内申请人仿制境外上市但境内未上市原研药品的药品。
②依据药品专利纠纷实施办法的规定,对于未在中国上市的原研药品,仿制药申请人可作出一类声明。故从相关规定本身而言,3类化学药品似乎应对应于一类声明。
③但需要注意的是,药品专利纠纷早期解决机制与药品注册制度毕竟是相互独立的两个制度,二者的独立性意味着无论是对于 3 类化学药品,还是对于一类声明,均应置于各自的法律制度中进行判断,而不能当然将3类化学药品对应于一类声明。
(4)对不同规格的仿制药的声明的看法
对于不同规格的仿制药的声明,不同法院的观点不同:
①一审认为:25mg、125mg哌柏西利片的获批并不意味着涉案75mg哌柏西利片原研药在中国可合法上市,75mg哌柏西利片原研药仍属于未在中国注册上市的药品,仿制药申请人针对75mg也只能作出一类声明。
②最高院不认同一审观点,认为:尽管在我国现行药品管理制度中,仅存在规格差异的化学药品也需要分别进行申请注册并获得不同的批号,但同一剂型的仿制药可以使用不同规格的原研药作为参比制剂,并将与该参比制剂质量和疗效一致性的数据作为申请注册的依据。故在与被仿制药仅存在规格差异的原研药已在专利信息登记平台中登记专利的情况下,如果认定仿制药申请人只能作出一类声明,则与我国药品审评审批实践不符,也与药品专利纠纷早期解决机制兼顾原研药专利权人和仿制药申请人及社会公众利益的目的不符。因此,该种情形下,仿制药申请人原则上应对照专利信息登记平台登记的该被仿制药其他规格项下登记的相关专利作出声明。即,最高院认为,就本案而言,应当做出4.1或4.2类声明。
③我方观点认为:
3类药声明适用于境内申请人仿制境外上市但境内未上市原研药品的药品,该类药品应与原研药品的质量和疗效一致的情况。事实上,还存在5类声明的情形,以此为例,想探讨3类声明的认定是否正确。
5类药声明适用于境外上市的药品申请在境内上市。5.1类适用于境外上市的原研药品,申请在境内上市;5.2类适用于境外上市的非原研药品,申请在境内上市。所以对于本案存在两种情形,我方认为:
①境外75mg原研已经上市,此时的专利声明可以是4类;
②境外75mg原研未上市,但境外有75mg仿制药上市,故此时的专利声明不应是4类,
所以,规格不同不一定要做4类声明。
案例三:福沙匹坦双葡甲胺对于专利声明的案例
国内目前还未有公开的相关案例,我们检索到福沙匹坦双葡甲胺案,美国新泽西地方法院于2013年判决。这里首先需要说明的是,美国是“拟制侵权”,在该程序中可以判断是否侵权,而我国是纠纷早期解决机制,不涉及侵权判定。故不能直接套用。
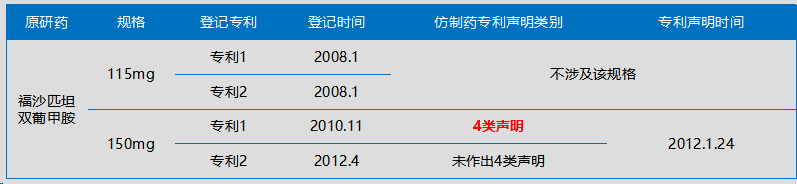
由于150mg的药品的专利2登记时间是2012年4月,而仿制药专利声明的时间是2012年1月24日,则仿制药做出的并非是4类声明。由此可见,不做4类声明也是有域外判例可参考的。
基于上述案例,我们可以总结出3类仿制药的声明策略:
①如果是剂型不同,且申报的剂型并未有专利登记,仿制药申请人可以作1类声明。
②如果是同一剂型、不同规格,则:
A纠纷解决优先:就其他规格下的登记专利作出相应声明(最高院判决);
B仿制药获批优先:依据境外是否有原研同规格上述,做出1类或4类声明。
(三)4.1类声明
案例四:尼洛替尼案((2022)京73民初210号)
尼洛替尼胶囊专利声明情况(ZL201080051819.0,2023-04-28撤销登记):
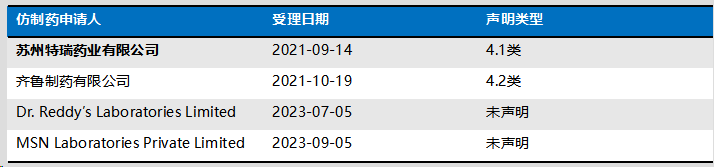
本案的权利要求和说明书记载情况如下:
①权利要求1:作为一水合物的4-甲基-N-[3-(4-甲基-咪唑-1-基)-5-三氟甲基-苯基]-3-(4-吡啶-3-基-嘧啶-2-基氨基)-苯甲酰胺的盐酸盐在制备用于治疗慢性粒细胞白血病的药物中的用途,其中所述的作为一水合物的4-甲基-N-[3-(4-甲基-咪唑-1-基)-5-三氟甲基-苯基]-3-(4-吡啶-3-基-嘧啶-2-基氨基)-苯甲酰胺的盐酸盐和可药用载体分散在苹果酱中。
②涉案原研药的剂型为胶囊剂,药品说明书中记载“对于不能吞咽胶囊的患者,可以把胶囊的内容物与一茶匙的苹果酱混合在一起,混匀后应立即服用”。
北京知识产权法院对于如何理解“分散”这一用语,认为:①对于何为“分散”,因涉案专利说明书中对其并无特别定义,因此,应基于该用语的字面含义,并将其置于权利要求1的整体语境中进行理解。权利要求1实际上可以简化表述为,“尼洛替尼(即权利要求1中的化合物)在制备用于治疗慢性粒细胞白血病的药物中的用途,其中尼洛替尼和可药用载体分散在苹果酱中”。对于这一表述方式,本领域技术人员通常会理解为,尼洛替尼具有治疗慢性粒细胞白血病的用途,该用途需要通过“药物”体现,该药物包括尼洛替尼、可药用载体及苹果酱。基于此,权利要求1应理解为被制备的药物中包括尼洛替尼、可药用载体、苹果酱三种成分,而非仅包括尼洛替尼、可药用载体两种成分。
②原告是否有权依据专利法第七十六条提起本案诉讼:如果涉案原研药并未落入涉案专利相关权利要求的保护范围,则专利权人及利害关系人无权依据专利法第七十六条提起确认落入保护范围之诉。涉案原研药作为尼洛替尼的胶囊制剂,其虽在药品说明书中记载“对于不能吞咽胶囊的患者,可以把胶囊的内容物与一茶匙的苹果酱混合在一起,混匀后应立即服用”,但苹果酱并非涉案原研药的成分之一。因此,涉案原研药并不包括涉案专利权利要求1的第一个技术特征, 未落入涉案专利权利要求1的保护范围。据此,涉案专利权利要求1不属于专利法第七十六条中规定的“与申请注册的药品相关的专利”,原告无权提起本案诉讼。
案例五:甲苯磺酸艾多沙班片((2022)国知药裁0012号)
该案有助于了解登记专利未覆盖原研药技术方案的处理。本案的裁决要点是,登记专利是否覆盖原研药技术方案并非法律规定的药品专利纠纷行政裁决程序需要主动审查的内容,当仿制药申请人提出异议并举证证明登记准确性确实存疑的情况下,合议组可以对该抗辩事由予以审理。
(四)4.2类声明问题
案例六:西格列汀二甲双胍片( (2023) 最高法知民终48号)
西格列汀二甲双胍片的专利声明(ZL200680047103.7)情况如下:
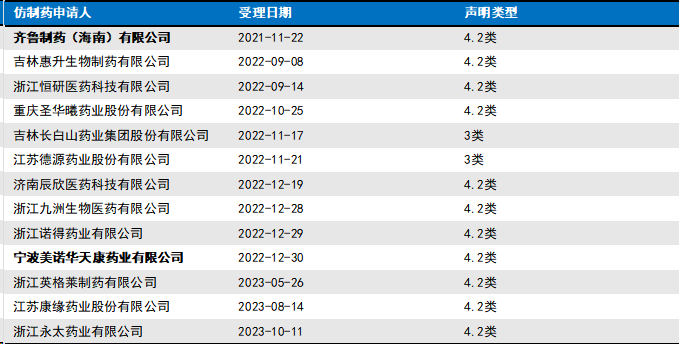
对于该案,我们想强调的是:
无论对于权利人还是仿制药企,都应该关注审查历史,且重视权利要求的修改和陈述,因为可能在申请的撰写,或者实审的答复中陈述的相关事实,后续程序可能被主张适用禁止反悔或者捐献原则:
法院确立了裁判规则——数值范围等同原则的适用:
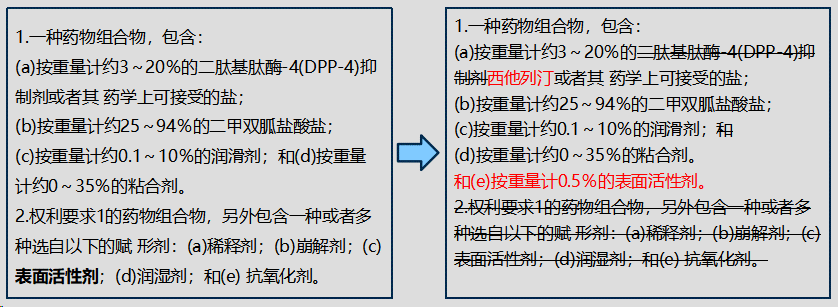
①说明书第[0045]段:在本发明的一种实施方案中,……在另一类中,药物组合物任选含有按重量计约0~3%的表面活性剂和/或按重量计约0~70%的稀释剂。在该类的亚类中,表面活性剂为月桂基硫酸钠和稀释剂为微晶纤维素。
②专利权人就“权利要求1得不到说明书的支持”的问题所做意见陈述:本申请所要解决的技术问题是,制剂应当与单独给药时的西他列汀和二甲双胍是生物等效的。在制剂中加入按重量计0.5%的表面活性剂对于解决上述技术问题是特别有用的。
最高人民法院观点认为:
①禁止反悔规则和捐献规则都可以构成适用等同原则的限制,其目的都是在公平保护专利权人的利益和维护社会公众利益之间实现合理的平衡。如果符合限制适用等同原则的条件,通常无需再判断两特征是否构成手段、功能、效果基本相同以及本领域技术人员是否无需创造性劳动即能联想。
②实质审查程序中,对于权利要求的修改并没有修改方式的限制,然而默沙东公司特意选定了“按重量计0.5%”这一点值,其并无证据或合理理由说明该修改存在文字表达局限、不能预见构成放弃、与争议的等同特征非紧密相关等可以认定并未放弃相应技术方案的情形,故依据该修改行为可以推定默沙东公司已放弃该点值之外的保护范围。
③默沙东公司在专利审查程序中,已通过强调其限定点值的优选技术方案具有特别技术效果,使其修改后的权利要求保护范围与说明书声称的发明所作出的贡献相适应,从而克服了审查意见通知书指出的实质性缺陷而获得授权。其已经在审查程序中通过意见陈述的行为作出明确意思表示,对修改后的权利要求保护范围进行了清晰明确的限定与说明,在确认是否落入专利权保护范围的判定中,不应再将排除在由该点值所限定的优选技术方案之外的数值纳入到专利权保护范围之内。
可以总结,数值范围等同侵权的判定规则可以参考:
①判断是否存在等同原则的限制原则(禁止反悔原则、捐献原则、特别排除原则、可预见性原则等);
②判断被诉方案所使用的数值与权利要求记载的数值是否在合理误差的范围内;
③判断被诉方案的数值技术特征与权利要求中相应的数值技术特征相比是否构成等同。
拟作出4.2类声明时进行专利规避的常见策略,可以参考以下几点:
①使用限制适用等同原则情形的技术方案(捐献原则、禁止反悔原则等);
②减少技术特征,规避全面覆盖原则;
③增加技术特征(封闭式权利要求);
④替换技术特征, 改变技术手段、功能和效果,规避等同原则;
⑤使用数值范围所允许的误差范围之外的技术特征。
案例七:艾地骨化醇软胶囊((2022) 最高法知民终905号)
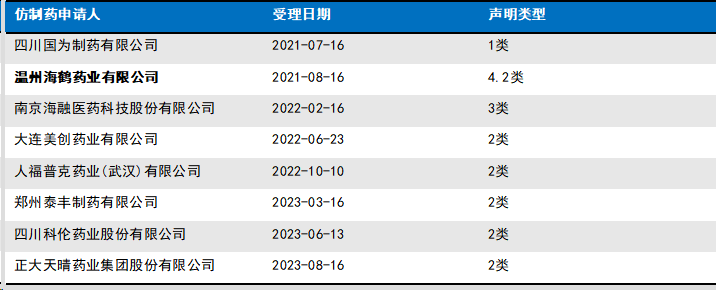
艾地骨化醇软胶囊案的专利声明情况(ZL200580009877.6):
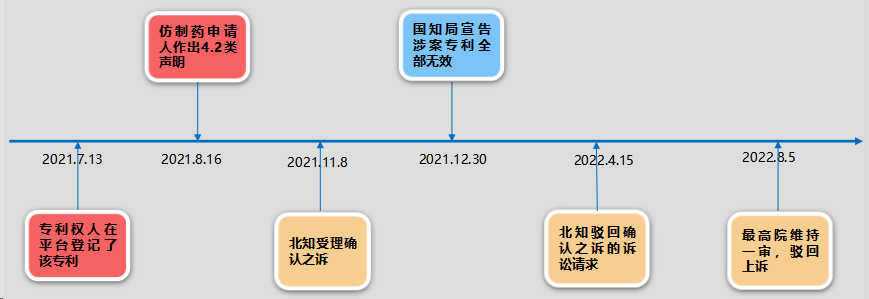
案件发生的流程如下:
最高人民法院观点认为:
①本案中,涉案专利权虽已被国家知识产权局宣告全部无效,但中外制药株式会社、海鹤公司均主张本案应进行实体审理,双方当事人均有在涉案仿制药上市前通过本案诉讼解决专利纠纷的意愿。且海鹤公司在本案中仅以涉案仿制药与涉案专利技术方案不同为由进行抗辩,涉案专利权的稳定性对本案争议问题的审理并无必然影响。因此,本院对本案继续进行实体审理。
②对于化学仿制药而言,国务院药品监督管理部门依据仿制药申请人的申报资料进行药品上市审评审批,并在规定的期限内根据人民法院对该类纠纷作出的生效裁判决定是否暂停批准相关药品上市,故在判断仿制药的技术方案是否落入专利权保护范围时,原则上应以仿制药申请人的申报资料为依据进行比对评判。如果仿制药申请人实际实施的技术方案与申报技术方案不一致,其需要依照药品监督管理相关法律法规承担法律责任;如果专利权人或利害关系人认为仿制药申请人实际实施的技术方案构成侵权,亦可另行提起侵害专利权纠纷之诉。因此,仿制药申请人实际实施的技术方案与申报资料是否相同,一般不属于确认落入专利权保护范围纠纷之诉的审查范围。
案例八:盐酸鲁拉西酮片((2022)最高法知民终2177号)
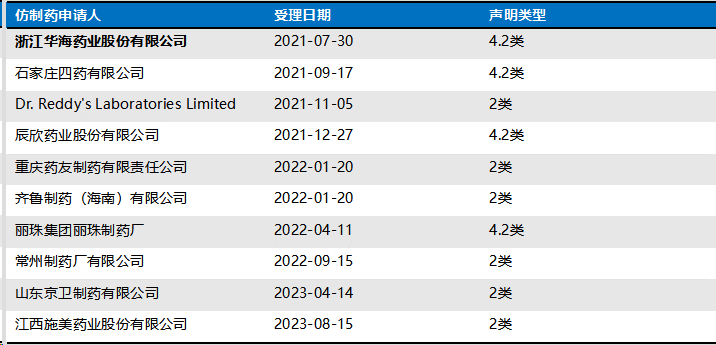
盐酸鲁拉西酮片的专利声明情况(40mg,ZL200680018223.4):
案件的流程如下:
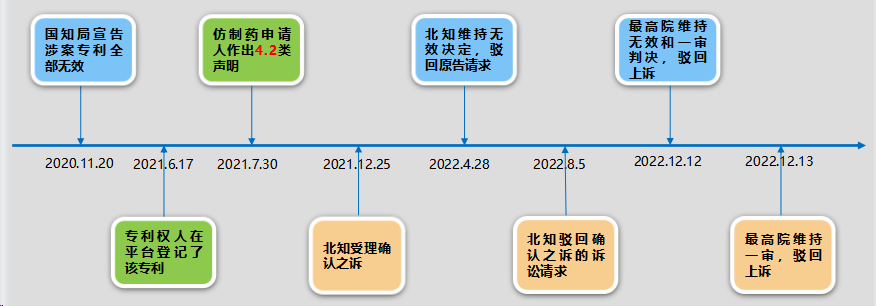
裁判规则围绕“先行裁驳、另行起诉”的参照适用展开。《最高人民法院关于审理侵犯专利权纠纷案件应用法律若干问题的解释(二)》第二条:“权利人在专利侵权诉讼中主张的权利要求被国务院专利行政部门宣告无效的,审理侵犯专利权纠纷案件的人民法院可以裁定驳回权利人基于该无效权利要求的起诉。
有证据证明宣告上述权利要求无效的决定被生效的行政判决撤销的,权利人可以另行起诉。”
最高人民法院观点表明:
①确认之诉可以参照适用“先行裁驳、另行起诉”的规定。国家知识产权局已宣告专利权无效、宣告专利权无效的审查决定尚未确定发生法律效力时的专利权在侵害专利权纠纷之诉和确认是否落入专利权保护范围纠纷之诉中应具有相同的地位,因此确认之诉可以参照适用该规定。
②先行裁定驳回起诉符合专利法设立药品专利纠纷早期解决机制的制度定位。药品专利纠纷早期解决机制既保护药品专利权人的合法权益,降低仿制药上市后专利侵权的风险,也保护仿制药企业公平的市场竞争行为,保证符合要求的仿制药的审批程序不会受到不合理影响。已被国家知识产权局宣告无效的专利权的状态很不稳定,以该类专利权为基础认定被诉仿制药技术方案是否落入涉案专利权的保护范围,很有可能无法实际达到早期解决药品专利纠纷的效果。
③先行裁定驳回起诉并不会导致双方当事人利益失衡。专利纠纷早期解决机制并非解决药品专利纠纷的唯一途径。若有证据证明宣告专利权无效的决定被生效的行政判决撤销,专利权人或利害关系人可以另行提起侵权之诉,其合法权益仍可以得到有效维护。相反,若在专利权状态很不稳定的情况下确认落入专利权保护范围,则很有可能导致仿制药上市审批的不当延迟。
④本案与在先裁判所涉情形不同。在(2022)最高法知民终905号案件中,本院进行实体审理系因双方当事人均主张该案应进行实体审理,均有在涉案仿制药上市前通过诉讼解决专利纠纷的意愿。该种情形下进行实体审理,不违反侵犯专利权纠纷解释(二)第二条中“可以”裁定驳回起诉的规定。
我们总结,涉案专利在诉讼过程中被全部无效但尚未确定发生法律效力时仿制药申请人的声明策略:
①如果是为了纠纷解决优先,案件可以继续审理,作出是否落入的判决(4.2类)。
②如果是为了仿制药获批优先,案件可以先行裁驳,另行起诉(2类、4.2类)。
三、总结
专利声明策略可以按照专利登记状态来选择无效、起诉和声明策略,汇总如下:
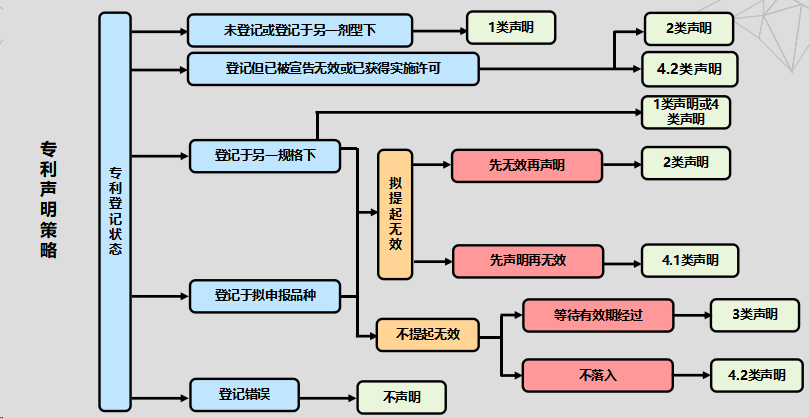
最后,存在有效登记专利时,选择3类或4类专利声明的考量因素可以分为以下几类,供各位参考:
①专利类型:化合物(3类、4.1类)、制剂(4.1类、4.2类)、用途(3类、4.1类、4.2类);
②专利到期日:到期日早(3类);到期日晚(4.1类、4.2类);
③专利保护范围:保护范围大(3类、4.1类)、保护范围小(4.2类);
④专利稳定性:稳定性高(3类、4.2类)、稳定性低(4.1类);
⑤首仿药独占期:获取独占期(4.1类、4.2类)、不获取独占期(3类)。
本文来源丨知产前沿
作者介绍

刘元霞
道可特总部管委会委员
道可特律师事务所高级合伙人、资深专利代理师
业务领域:专利侵权和无效、专利申请、答复和复审、非诉法律服务(FTO,有效性等) 、反垄断、商业秘密
邮箱:liuyuanxia@dtlawyers.com.cn
可能感兴趣
专业团队
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
行业研究
更多-
《全国保险行业法律健康指数报告(2015-2017)》《全国保险行业法律健康指数报告(2015-2017)》是由绿法(国际)联盟(GLGA)作为编制单位,北京市道可特律师事务所作为专业支持单位,并在外部专家团队的指导下,共同打造的资本市场行业法律健康指数报告系列研究课题之一。2017年,绿法(国际)联盟(GLGA)成功发布了其资本市场行业法律健康指数报告系列研究课题的首份研究成果,即《私募基金行业法律健康指数报告》。《保险行业法律健康指数报告》是该研究课题的第二份研究成果。 -
《2018中国保险行业法律健康蓝皮书》《2018中国保险行业法律健康蓝皮书》包括上篇《保险行业法律健康指数报告》及下篇《保险行业法律专题报告》。其中,《保险行业法律健康指数报告》是由绿法(国际)联盟(GLGA)继2018年成功发布首份《保险行业法律健康指数报告》之后连续第二年发布,该指数能够综合、直观反映近三年来保险行业整体的法律健康状态。《保险行业法律专题报告》则结合近年来保险行业及保险资金运用领域法律实务,针对当下行业实务中的热点及疑难复杂问题,从法律视角予以分析和解读,以期为保险行业及保险资金运用的合法合规发展提供一些意见和建议。 -
《央企(A股)上市公司法律健康指数报告》《央企(A股)上市公司法律健康指数报告》是目前市场上首份以法律健康为导向和评判标准的、研究央企(A股)上市公司发展健康度的指数报告,是第一份由第三方机构推出的带有公益性和学术性的央企(A股)上市公司指数报告,是研究、评价央企(A股)上市公司的一个全新视角与一项创新性举措。报告对央企(A股)上市公司的健康度做了全视角、多层次的分析和解读;报告以动态发展的数据库为支撑,在绿法(国际)联盟(GLGA)的协调下与相关监管部门、治理机构、重要行业组织、经营主体形成互动机制,围绕央企(A股)上市公司开展长期跟踪研究,努力推出对认识央企(A股)上市公司、推进央企(A股)上市公司发展具有重要影响的学术成果。
品牌活动
更多-
[12/08]创新与信心:律所管理的未来——道可特2024行业论坛
世界格局加速变迁,各行业生态持续重塑,法律行业亦置身变革潮头,面临各种考验:如何在饱和市场中“活下来”?行业信心从何而来?创新同质化,下一步怎么走?国际化之路还要坚持吗?如何与其他专业服务机构协同向上?重塑思考,破题解卷。12月8日,道可特律师事务所作为主办方,携手专业服务机构与八所高校,带来一场关于“创新”与“信心”的行业论坛。 -
[03/22]道可特2024创新季启动仪式
当“新质生产力”成为两会C位词,各行业、各地区纷纷发力,竭力做好创新这篇大文章。法律行业不外如是。随着时代发展和法律行业的变革,创新已成为律所提升竞争力的关键。敢于求变,勇做破局者;勇于求新,争做开创者也是道可特一直坚持的发展内核。 -
[12/27]地方型律所的发展路径选择和竞争力打造专题研讨会暨道可特济南办公室成立五周年庆典
2018年,道可特落子泉城,设立道可特济南办公室。作为道可特第二家分所,济南办公室定位于品牌市场旗舰店和道可特全国法律市场开发试点,是道可特在专业化、规模化、品牌化发展道路上迈出的重要一步。依托总部一体化管理平台,立足区域优势,历时五载春秋更迭,济南办公室实现了自身跨越式的发展,也见证了区域法律行业的发展与变化:行业竞争加剧、业务半径有限、人才引力不足,品牌规划不明晰……如何破茧、突围正在成为区域律所亟待解决的难题。2023年12月27日,在道可特济南办公室成立五周年之际,我们将举办“地方型律所的发展路径选择和竞争力打造专题研讨会暨道可特济南办公室成立五周年庆典”。届时,各界行业翘楚、知名媒体机构代表等嘉宾将悉数出席。


